Đầu năm 2020, Bộ KH&CN từng tổ chức họp báo giới thiệu bộ kit test COVID-19 của Công ty Việt Á phối hợp cùng Học viện Quân y nghiên cứu, sản xuất.
Buổi họp báo công bố kết quả nghiên cứu chế tạo bộ sinh phẩm Real Time RT-PCR One Step phát hiện virus corona chủng mới (SARS-CoV-2) do Học viện Quân y phối hợp cùng Công ty Việt Á nghiên cứu và sản xuất, được Bộ Khoa học và Công nghệ (KH&CN) tổ chức ngày 5/3/2020.
Theo đại diện nhóm nghiên cứu, kết quả thử nghiệm chính xác 100% tại tất cả các thiết bị và các lần thử nghiệm, bộ kit chính thức được Bộ Y tế cấp phép cho sản xuất. Với ưu điểm vượt trội và thời gian bộ kit cho kết quả chỉ khoảng 2 giờ, nhanh gấp 4 lần so với bộ kit đang sử dụng thời điểm đó.
 |
| Thứ trưởng Bộ KH&CN Phạm Công Tạc chủ trì buổi họp báo công bố kết quả nghiên cứu chế tạo bộ sinh phẩm Real Time RT-PCR One Step phát hiện virus corona chủng mới (SARS-CoV-2) do Học viện Quân y phối hợp cùng Công ty Việt Á nghiên cứu và sản xuất hồi tháng 3/2020. (Ảnh: TTXVN) |
Trả lời báo chí khi đó, Trung tướng GS.TS Đỗ Quyết, Giám đốc Học viện Quân y cho biết, bộ kit này có thể ứng dụng cho nhiều máy của Real Time PCR đang được trang bị các Labo của rất nhiều bệnh viện và cơ sở nghiên cứu, chẩn đoán của Việt Nam. Chính vì vậy, bộ kit có thể được đưa vào áp dụng rộng rãi ngay lập tức.
Đáng chú ý, thông tin đưa ra tại buổi họp báo bộ kit này còn được các chuyên gia y tế của Tổ chức Y tế thế giới (WHO) và Trung tâm dự phòng kiểm soát bệnh tật (CDC) Mỹ đánh giá tương thích với hầu hết các hệ thống Labo xét nghiệm của các cơ sở y tế hiện nay với độ nhạy, độ đặc hiệu và độ chính xác cao.
Nhấn mạnh thêm, ông Hoàng Xuân Sử, đại diện Học viện Quân y cho biết, các bộ kit của WHO hầu hết đều chạy 2 phản ứng, sinh phẩm của CDC Mỹ cũng phải chạy tới 4 phản ứng. Tương ứng như bộ kit của WHO thời gian sẽ gấp lên 2 lần còn đối với CDC Mỹ sẽ là 4 lần. “Tuy nhiên, chúng tôi đã nghiên cứu để tối ưu hoá bộ kit để giảm được thời gian cho kết quả xét nghiệm cũng như giảm được giá thành của 1 lần xét nghiệm”, ông Sử nói.
Là đơn vị trực tiếp sản xuất bộ kit test, Công ty Việt Á còn hứa hẹn, mỗi ngày họ có thể sản xuất được 10.000 bộ kit, đảm bảo cung ứng số lượng cần dùng trong trường hợp dịch bùng phát rộng. Phan Quốc Việt, Tổng Giám đốc Công ty Cổ phẩn công nghệ Việt Á quả quyết điều này, thậm chí nếu tăng công suất, trong một ngày, Việt Á có thể sản xuất tới 30.000 bộ kit như vậy. Ông này còn khẳng định thêm, tất cả bộ kit đều trải qua quy trình rất nghiêm ngặt trên những mẫu bệnh phẩm lâm sàng trước đó đã được kiểm nghiệm với kit của CDC kết quả tương thích.
Tại buổi họp báo, chuyên gia cho rằng, việc sản xuất được bộ kit test nhanh phát hiện SARS-CoV-2 sẽ giúp cho Việt Nam chủ động trong trường hợp dịch bùng phát trong phạm vi lớn, giúp sớm phát hiện các bệnh để cách ly nhanh chóng, hạn chế lây lan trong cộng đồng.
Bộ KH&CN “chứng nhận hộ” WHO?
Ngày 26/4/2020, Cổng thông tin điện tử của Bộ Khoa học và Công nghệ đăng tải: "Bộ KIT xét nghiệm COVID-19 của Việt Nam sản xuất vừa được Tổ chức Y tế thế giới chấp thuận". Trong đó nêu rõ: "Ngày 24/4, Tổ chức Y tế thế giới đã chấp thuận bộ KIT xét nghiệm COVID-19 của Việt Nam do Bộ Khoa học - Công nghệ giao cho Học viện Quân y và Công ty cổ phần Công nghệ Việt Á phối hợp nghiên cứu và sản xuất. WHO đã đánh giá bộ kit theo quy trình danh sách khẩn cấp (EUL) và cấp mã số EUL 0524-210-00".
Trong khi đó, ngày 20/10/2020, WHO công bố báo cáo công khai về đánh giá sử dụng khẩn cấp của WHO thẩm định bộ xét nghiệm COVID-19 của Việt Á là: “Not Accepted - Không được chấp nhận”.
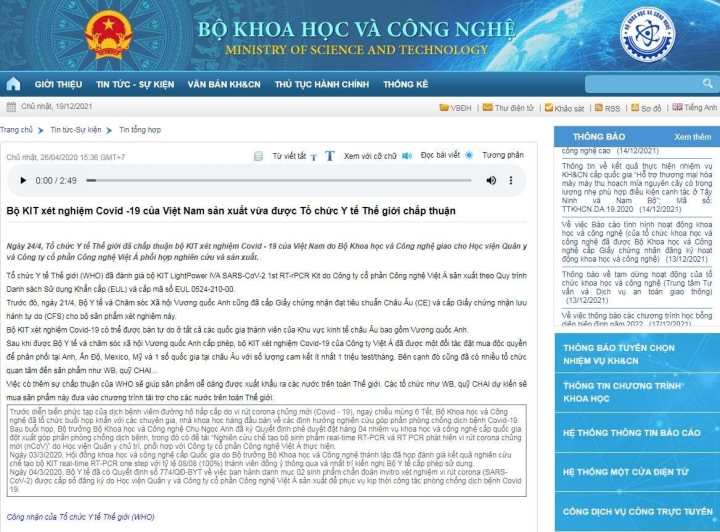 |
| Thông tin "WHO đã đánh giá bộ kit do Công ty Việt Á sản xuất theo quy trình Danh sách khẩn cấp (EUL) và cấp mã số EUL 0524-210-00" đăng tải trên Cổng thông tin của Bộ KH&CN ngày 26/4/2020. |
Gần đây nhất, 10/12, theo danh sách "SARS‐CoV‐2 IVDs: sản phẩm không được chấp thuận sử dụng khẩn cấp (EUL)" đăng tải trên website chính thức của Tổ chức Y tế thế giới (WHO) vẫn có tên bộ xét nghiệm LightPower iVASARS-CoV-2 1stRT-rPCR Kit, mã số sản phẩm VA.A02-055H, số hồ sơ đăng ký EUL 0524-210-00 của Công ty cổ phần Công nghệ Việt Á.
Ngày 20/12/2021, trả lời VTC News, đại diện Bộ KH&CN thừa nhận Bộ này có sai sót trong việc thông tin bộ kit test của Công ty Việt Á được WHO chấp thuận.
Về lý do, ông Trịnh Thanh Hùng, Phó Vụ trưởng Vụ KH&CN các khối ngành Kinh tế - Kỹ thuật, Bộ KH&CN, thừa nhận, Bộ KH&CN chưa xem xét kỹ lưỡng thông tin phản hồi của WHO về bộ kit test của Công ty Việt Á. Thực chất WHO mới chỉ "chấp thuận đưa kit test này vào quy trình đánh giá xem xét sử dụng" không phải "chấp thuận sử dụng". "Đây là sơ suất của Bộ Khoa học và Công nghệ", ông nói.
Qua tìm hiểu, trên website của Bộ KH&CN, thông tin công bố đánh giá của Tổ chức Y tế thế giới (WHO) và Bộ Y tế Anh cấp chứng nhận đạt chuẩn châu Âu cho bộ kit test của Công ty cổ phần Công nghệ Việt Á cũng đã bị gỡ bỏ.
Về băn khoăn kit test không được WHO chấp thuận nhưng vẫn đưa sản phẩm này vào sử dụng trong 2 năm chống dịch, ông Hùng nhấn mạnh, việc WHO chấp nhận hay không chấp nhận độc lập với quyết định cấp phép sử dụng của Bộ Y tế.
Cấp phép dựa trên căn cứ Bộ KH&CN
Theo đại diện Bộ Y tế, trước đó ngày 3/3/2020, Hội đồng đánh giá, nghiệm thu kết quả giai đoạn 1 đề tài độc lập cấp quốc gia đột xuất phòng chống dịch bệnh viêm đường hô hấp cấp do chủng mới của virus corona đã họp (Hội đồng của Bộ KH&CN). Đề tài tên "Nghiên cứu chế tạo bộ sinh phẩm RT-PCR và realtime RT-PCR phát hiện chủng virus corona mới 2019 (2019-nCoV)".
Hội đồng đề nghị Bộ Y tế cấp phép sử dụng cho 2 bộ sinh phẩm realtime PCR chẩn đoán SARS-CoV-2 (LightPoweriVA SARS-CoV-2 1st RT-PCR Kit, LightPoweriVA SARS-CoV-2 1st RT-rPCR Kit). Đây là kết quả của nhiệm vụ khoa học và công nghệ cấp quốc gia do Bộ KH&CN phê duyệt, được thực hiện giữa Học viện Quân y và Công ty cổ phần Công nghệ Việt Á.
Căn cứ vào ý kiến của Hội đồng nói trên, kết quả đánh giá đáp ứng về độ nhạy, độ đặc hiệu của Viện Vệ sinh dịch tễ Trung ương, cũng như kết quả xác nhận cơ sở sản xuất của Công ty đạt tiêu chuẩn ISO 13485:2016 do Tổ chức Bureau Veritas cấp (tổ chức được Bộ KH&CN công nhận), Bộ Y tế cấp phép sử dụng tạm thời cho 2 bộ sinh phẩm nói trên thời hạn 6 tháng vào ngày 4/3/2020 để sử dụng trong xét nghiệm sàng lọc.
“Việc cấp phép này đảm bảo đáp ứng nhu cầu xét nghiệm tại thời điểm rất khó khăn khi tiếp cận với nguồn cung ứng sinh phẩm trên thế giới”, đại diện Bộ Y tế cho biết.
 |
| Bộ Y tế khẳng định cấp phép cho bộ kit test của Công ty Việt Á là đúng quy định.(Ảnh: BL) |
Tiếp đó, đến 4/12/2020, Bộ Y tế quyết định cấp phép lưu hành 5 năm đối với bộ sinh phẩm xét nghiệm SARS-CoV-2 chủng loại LightPoweriVA SARS-CoV-2 1st RT-rPCR Kit của Công ty cổ phần Công nghệ Việt Á.
“Bộ Y tế xác định việc cấp phép cho nhiều sản phẩm là để tăng cường nội địa hóa, chủ động nguồn cung và tạo sự cạnh tranh về giá sinh phẩm xét nghiệm. Tất cả các sản phẩm cấp phép đều đã được đánh giá đạt yêu cầu, đáp ứng tiêu chuẩn, chất lượng của Việt Nam và đảm bảo đúng theo các quy định hiện hành. Các sản phẩm sau khi được cấp phép đều được theo dõi chất lượng và tính ổn định”, Bộ Y tế thông tin.
Về băn khoăn, sản phẩm kit test của Việt Á không được Tổ chức Y tế thế giới (WHO) chấp thuận nhưng vẫn được Bộ Y tế cấp phép, đại diện Bộ này khẳng định, danh mục các sinh phẩm do WHO công bố và đưa vào danh sách sử dụng khẩn cấp (EUL), các công ty mong muốn sản phẩm của mình được đưa vào danh sách của WHO thì nộp hồ sơ đề nghị xem xét.
Tuy nhiên, mỗi quốc gia, tổ chức đều xây dựng tiêu chí và yêu cầu về hồ sơ, sản phẩm khác nhau về việc chấp thuận lưu hành sinh phẩm. Các công ty có nhu cầu lưu hành, sử dụng tại quốc gia và tổ chức nào sẽ nộp hồ sơ theo quy định của từng tổ chức, quốc gia đó.
Do vậy, việc cấp phép của Bộ Y tế đối với sản phẩm của Công ty cổ phần Công nghệ Việt Á và các nhà sản xuất khác không phụ thuộc vào danh sách do WHO công bố.
Theo điều tra, Công ty Việt Á do Phan Quốc Việt thành lập. Tháng 3/2020, sau khi Hội đồng Khoa học và Công nghệ quốc gia thông qua, Bộ Y tế đã cấp phép đăng ký lưu hành cho sản phẩm kit xét nghiệm SARS-CoV-2 của Công ty Việt Á.
Phan Quốc Việt và thuộc cấp khai lợi dụng tính cấp bách về nhu cầu thiết bị xét nghiệm SARS-CoV-2 của các địa phương trên cả nước, trong đó có tỉnh Hải Dương. Việt và ông Phạm Duy Tuyến (Giám đốc CDC Hải Dương) thỏa thuận để Công ty Việt Á cung cấp sản phẩm cho CDC Hải Dương sử dụng trước, sau đó mới hợp thức thủ tục đấu thầu theo hình thức chỉ định thầu rút gọn.
Bộ Công an cho rằng Công ty Việt Á đã bán kit xét nghiệm cho CDC Hải Dương thông qua 5 hợp đồng với tổng giá trị 151 tỷ đồng. Trong đó, bị can Việt đã chi tiền phần trăm ngoài hợp đồng cho ông Tuyến gần 30 tỷ đồng. Cơ quan điều tra Bộ Công an tiếp tục mở rộng vụ án đối với các cá nhân, đơn vị liên quan để đảm bảo thu hồi tài sản cho Nhà nước.
PHẠM QUÝ